El pasado 24 de julio se cumplieron 104 años del nacimiento de la doctora Frances K. Oldham Kelsey [1]. Si nunca has oído hablar de ella, sigue leyendo, porque es una de esas personas que nos han dado mucho y no han recibido el reconocimiento que se merecen.
Frances Kelsey nació en Canadá, donde se graduó y obtuvo un máster en farmacología. Posteriormente cursó su doctorado en la Universidad de Chicago. En una época en la que pocas mujeres eran admitidas para obtener educación superior, su carta de aceptación en la Universidad de Chicago iba dirigida a “Mr. Oldham”, lo que no impidió su aceptación y que destacase entre una mayoría de varones.
Tras obtener su doctorado en farmacología, se graduó como doctora en medicina. Sin embargo, su mayor contribución a la ciencia no provino de su faceta como científica, sino como burócrata.
En 1938, en Estados Unidos se aprobó la “Federal Food, Drug and Cosmetic Act”, que entregaba a la Food and Drug Administration (FDA) la capacidad de aprobar o rechazar la comercialización de cualquier alimento, medicamento o cosmético en los Estados Unidos, en base a su seguridad. Esta ley fue completamente revolucionaria, no tenía equivalente en la comunidad internacional, y obligaba a los fabricantes, en principio, a demostrar a la FDA que sus productos eran seguros para poder comercializarlos en suelo estadounidense.
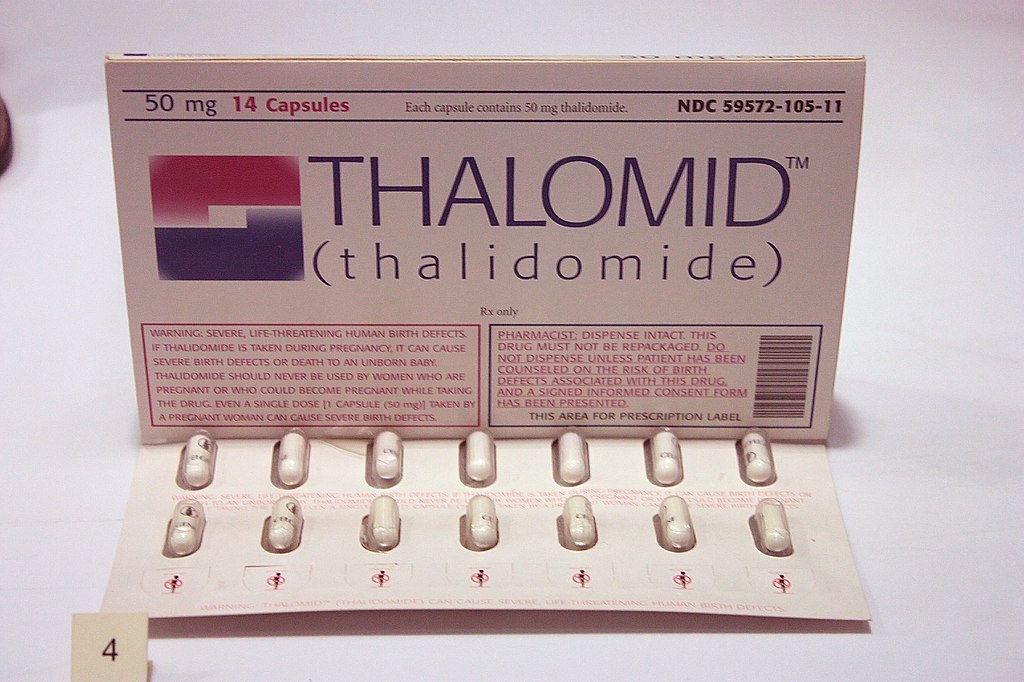
Mientras tanto, en 1957, un “revolucionario” medicamento apareció en Alemania, la talidomida, que se prescribió como sedante y calmante de las náuseas durante el embarazo. En los años siguientes se extendió su uso por todo el mundo, especialmente Europa, América, Japón, Australia, etc. En ninguno de estos países existía legislación que obligase a demostrar la seguridad de este medicamento, y se escudaban en afirmaciones vagas, como que el fármaco no traspasaba la barrera que representa la placenta. Rápidamente comenzaron a reportarse casos de abortos espontáneos ocurridos a madres que habían tomado la talidomida, y bebés nacidos con grandes deformaciones, algunas tan severas que muchos bebés morían al poco tiempo de nacer.
En 1960, tres años después, Frances Kelsey fue contratada por la FDA para revisar solicitudes de comercialización de medicamentos. Como primera tarea se le asignó un caso a priori sencillo: supervisar la introducción de la talidomida, que ya se estaba prescribiendo ampliamente a embarazadas del resto del mundo, incluyendo países vecinos como Canadá. Gracias a su experiencia previa en la investigación sobre el paso de medicamentos a través de la placenta, la doctora Kelsey decidió paralizar la comercialización del medicamento, exigiendo pruebas de que su uso no perjudicaba el desarrollo del feto. Sin embargo, los comercializadores de la talidomida no se dieron por vencidos, y apelaron a un resquicio legal que les permitiría la distribución “experimental” del medicamento, mientras se llevaban a cabo los estudios pertinentes. Frances, horrorizada, denegó tal posibilidad, y reiteró su exigencia de nuevos estudios para considerar la comercialización de la talidomida. Desde la farmacéutica incrementaron la presión sobre la Dra. Kelsey, sobre la FDA y la opinión pública, intentado incluso apartarla de su puesto, pero Frances recibió reiteradamente el apoyo de sus superiores, actuando como un cortafuegos a la comercialización del medicamento.
Tres años más tarde, la situación se volvió insostenible a nivel mundial. Aunque no se dispone de cifras oficiales, se estima que entre 10.000 y 100.000 bebés nacieron en todo el mundo con malformaciones graves debidas al uso de la talidomida. Ante esta evidencia y el trabajo de numerosos investigadores que mostraron la gravedad del problema, todos los países del mundo comenzaron a prohibir su distribución. Sin embargo, en países como España no se admitió el problema y se siguió distribuyendo, de manera no legal, hasta mediado de los años 80 [3]. Oficialmente, gracias a la tenacidad de Frances Kelsey, en Estados Unidos sólo se registraron 17 casos de afectados, en principio ocurridos por una distribución no legal del medicamento. Por comparación, en Canadá, su país vecino, con una décima parte de población, se registraron 10 veces más casos de bebés afectados [4] [5].
La fortaleza y profesionalidad de la Dra. Kelsey, y el apoyo de sus compañeros en la FDA y científicos trabajando por la seguridad de los medicamentos, fue esencial para defender la suma importancia de los ensayos pre-clínicos y clínicos a la hora de desarrollar fármacos. Extrapolando datos de otros países, sólo con la prudencia mostrada por la Dra. Kelsey, se evitaron miles de abortos no deseados y malformaciones. Como reconocimiento a su gran labor, Frances recibió en 1962 el President´s Award for Distinguished Federal Civilian Service, convirtiéndose en la segunda mujer en recibirlo (la primera fue Hazel K. Stiebeling, en 1959, por trabajar contra la desnutrición y malnutrición en los EEUU y en el mundo).

La Dra. Frances K. Oldham Kelsey recibiendo el reconocimiento presidencial de la mano de John F Kennedy [2].
Sin embargo, la necesidad de incrementar los ensayos antes de aprobar nuevos medicamentes también conlleva sus problemas. Por un lado, se hace imprescindible el ensayo en animales antes de hacer pruebas en humanos, con los debates éticos que la práctica conlleva. Además, ningún modelo animal es perfecto, y es claramente posible que en esta fase se acepten medicamentos que posteriormente no serán válidos en humanos, o por el contrario se descartarán medicamentos que sí serían viables. Por otra parte, las pruebas en humanos nunca estarán exentas de riesgos y serán lentas y muy costosas. De este modo, a la par que hemos incrementado la seguridad de los medicamentos, hemos aumentado enormemente los tiempos de desarrollo de medicamentos y los costes asociados.
Desde el IBEC se están desarrollando varias iniciativas dirigidas a reducir tanto los costes como los tiempos de desarrollo de nuevos medicamentos. Estos proyectos van desde la simulación numérica del comportamiento de los fármacos (desarrollos in silico) [6]; el desarrollo de órganos en un chip, que simulan el comportamiento de los órganos humanos, en los que se podrán probar la difusión y absorción de medicamentos [7]; la creación de organoides para realizar baterías de tests en paralelo de alto rendimiento[8]; la impresión en 3D de tejidos reales para estudiar el efecto de los medicamentos en órganos humanos reales sin poner en peligro a ningún paciente [9]; y un largo etcétera. Gracias a este esfuerzo conjunto de diversos grupos de investigación, todo apunta a que en el futuro podremos disfrutar de medicamentos más seguros y obtenidos mediante un proceso más corto y barato de innovación en su desarrollo.
Referencias:
[1] https://en.wikipedia.org/wiki/Frances_Oldham_Kelsey
[2] https://www.fda.gov/aboutfda/history/virtualhistory/historyexhibits/ucm345094.htm
[4] https://www.cbc.ca/news/health/thalidomide-explainer-1.4434746
[5] http://epe.lac-bac.gc.ca/100/205/301/ic/cdc/heirloom_series/volume6/218-219.htm
[6] http://boletindenoticias.fundacionbotin.org/Ciencia/junio2018/transferencia2.pdf
[7] http://divulga.ibecbarcelona.eu/organos-en-un-chip-para-combatir-la-diabetes/
[8] http://divulga.ibecbarcelona.eu/organoides-para-estudiar-el-cancer-de-colon/
[9] http://divulga.ibecbarcelona.eu/imprimiendo-tejidos-vivos/
[10] https://www.youtube.com/watch?v=LUE9xhu5Gm0&ab_channel=Atodaleche
Autor: Manuel Gómez, investigador postdoctoral
grupo Integrative Cell and Tissue Dynamics del IBEC