El miércoles pasado la Real Academia Sueca de las Ciencias premió con el Nobel de Química a la técnica de criomicroscopía electrónica, una variante de la microscopía electrónica que ha permitido a los científicos ver las biomoléculas aún más de cerca. El hallazgo, fruto del trabajo del suizo Jacques Dubochet, el germano-estadounidense Joachim Frank y el británico Richard Henderson, nos han permitido ver en 3D y con alta resolución las moléculas esenciales para la vida.
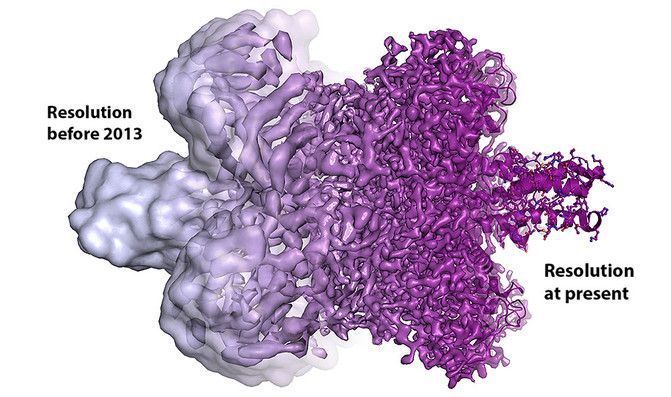
Evolución de la resolución de una biomolécula desde antes de 2013 a la actualidad. / Martin Högbom/The Royal Swedish Academy of Sciences
Una imagen vale más que mil palabras
Las imágenes son esenciales para entender cualquier proceso. Muchos descubrimientos científicos son posibles gracias a poder visualizar objetos invisibles a simple vista. Durante muchos años, la bioquímica ha sido “invisible” incluso para los investigadores, pues la tecnología disponible no podía generar imágenes de la maquinaria molecular de la vida (del orden de los nanómetros).
La criomicroscopia electrónica, o como se la conoce habitualmente, la Cryo-SEM (del inglés Cryo-Scanning Electron Microscopy) ha hecho visible lo invisible. Gracias a ella, los científicos ya pueden congelar biomoléculas en movimiento y visualizar procesos que nunca antes se habían visto, lo que puede ser decisivo para la comprensión básica de la química de la vida y posteriormente para el desarrollo de productos farmacéuticos.
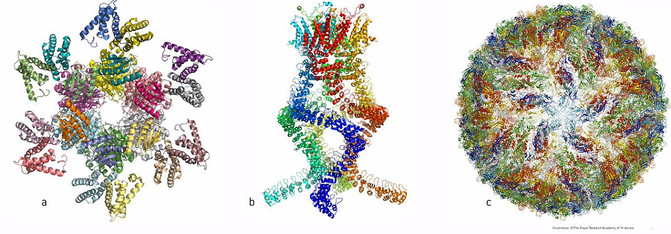
Ejemplos de estructuras atómicas de biomoléculas conseguidas con criomicroscopia electrónica : a) proteína que controla los ritmos circadianos, b) sensor auditivo y c) virus del Zika. / The Royal Swedish Academy of Sciences
Los ojos del microscopio electrónico: un haz de electrones

Pulsa para ampliar. Poster sobre la microscopía electrónica de barrido editado por ZEISS Microscopy; licencia wikimedia commons.
La microscopía electrónica utiliza un haz de electrones en lugar de un haz de luz para formar una imagen.
El haz de electrones se produce calentando un filamento metálico. Al ponerse incandescente, este produce una nube de electrones a su alrededor – se le llama efecto termoiónico -. Una gran diferencia de potencial (de entre 50 y 30000 kilovoltios) acelera a los electrones libres, que bajo esas condiciones se comportan como ondas – igual que haría la luz. La diferencia es que la longitud de onda de los electrones es mucho mas corta, del orden de las décimas de nanómetro. Esta radiación, además de no ser visible, permite ver dos puntos separados por un nanómetro como dos posiciones distintas, lo que permite ver la muestra con muchísima resolución, como si la escanearas muy muy “de cerca”.
Interacción haz-muestra
El haz de electrones se dirige y enfoca sobre la superficie de la muestra con lentes electromagnéticas, un tipo de lentes especiales que pueden “ver” e interaccionar con los electrones, pues las lentes ópticas no pueden hacerlo más que con fotones (la unidad de luz).
Cuando el haz incide sobre la muestra, se producen muchas interacciones entre los electrones del haz y los átomos de la muestra; puede haber, por ejemplo, electrones que reboten como las bolas de billar. Por otra parte, la energía que pierden los electrones al “chocar” contra la muestra puede hacer que otros electrones salgan despedidos (electrones secundarios). La mayoría de las imágenes de microscopios de barrido se toman detectando los electrones secundarios que salen despedidos de la muestra.
La microscopía SEM es una técnica de microscopía de barrido; esto significa que el haz de electrones impacta sobre la superficie de la muestra trazando un recorrido por filas, como lo haría una impresora 3D para depositar la tinta. Además, como la radiación de los electrones no es visible, las imágenes obtenidas en un microscopio electrónico siempre son en blanco y negro.
Preparando mi primera muestra para Cryo-SEM: El secreto está en vitrificar la muestra
Una peculiaridad de la microscopía electrónica es que las muestras han de ser conductoras para poder interaccionar con el haz de electrones incidente y que se pueda crear una imagen. La muestra generalmente se recubre con una capa de carbono o una capa delgada de un metal, como el oro, si no es conductora de forma natural. De hecho, durante mucho tiempo se pensó que los microscopios electrónicos no eran adecuados para captar imágenes de muestras biológicas, pues el propio haz de electrones puede dañar o romper las moléculas orgánicas de la muestra. El gran avance en la microscopía electrónica lo supuso poder usar agua en las muestras biológicas. Aunque el agua líquida se evapora en el vacío que hay dentro de estos microscopios (con el consiguiente colapso de las biomoléculas de la muestra), Dubochet consiguió esquivar este problema vitrificando el agua de las muestras: la enfrió con tanta rapidez que se solidificó en su forma líquida (amorfa) y no sólida (cristalina) alrededor de las muestra biológicas, permitiendo así que las biomoléculas conservaran su forma natural, incluso en el vacío. A este proceso se le llama criogenización (nota 1).
Estructura de la enzima Alcohol Oxidasa de la levadura Pichia pastoris obtenida con Criomicroscopía electrónica.
El potencial de esta técnica está en que ayuda a entender cómo funcionan las moléculas dentro de la célula. En particular, la criomicroscopía electrónica llena un vacío que existía a la hora de observar estructuras de un tamaño inferior al de una célula o una bacteria, como los virus. Como señala la Academia Sueca de las Ciencias en un comunicado, “la bioquímica se enfrenta ahora a un desarrollo explosivo, pero está preparada para ese futuro emocionante”.
Los galardonados con el Nobel fueron pioneros en el desarrollo de aspectos claves de la práctica: Dubochet, desde el proceso de congelación; Henderson, en la tecnología, y Frank, en los métodos computacionales para reconstruir las imágenes adquiridas en 3D.
Nota 1: Durante el proceso de solidificación del agua, se crean cristales de hielo que pueden dañar y romper las estructuras y biomoléculas de la muestra de forma irreversible.
Bibliografía
Microscopio electrónico de barrido (2017)
Diario El Mercurio (Chile): ¿En qué consiste la técnica de “criomicroscopía electrónica” que recibió el Nobel de Química? (2017)
Agencia SINC: “Nobel de Química para los científicos que retratan las moléculas de la vida” (2017)
Universidad de Oviedo: “¿Sabías que…? VII Semana de la Ciencia y la Tecnología” (2007)
Manipulación de muestras para su estudio al Microscopio Electrónico; Universidad de Murcia (2008)
“Principios y práctica de la microscopía electrónica”; UAT-CONICET-BAHIABLANCA; Sorrivas de Lozano, Viviana. Alfonsina Morales. María Julia Yañez (2014)
Autora: Pilar Rodríguez-Franco